AG Clauß
-
AG Clauss – Experimentelle und translationale Elektrophysiologie
In der AG Clauss untersuchen wir Mechanismen, die zu Arrhythmien führen. Von genetischen, molekularen und zellulären Signalwegen bis hin zu autonomen und immunologischen Einflüssen wollen wir verstehen, was proarrhythmisches Remodelling antreibt. Ein vertieftes Verständnis dieser Prozesse hilft uns, die Signalwege zu identifizieren, die zur Entstehung von Arrhythmien beitragen, und darauf aufbauend neue therapeutische Strategien zu entwickeln und zu testen. Die Kombination unserer Erkenntnisse aus In-vitro-, Maus- und Schweinemodellen ermöglicht es uns, Ergebnisse aus der Forschung in die klinische Praxis zu begleiten.

Aktuelle Projekte
Myeloide Interaktionen in Herz-Kreislauf-Erkrankungen
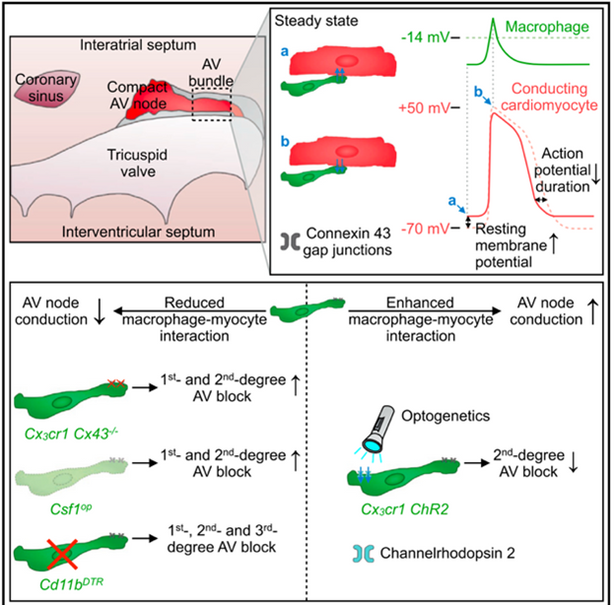
Arbeiten der AG Clauss zusammen mit unseren Kooperationspartnern implizieren kardiale residente Makrophagen (CRMs) in der physiologischen Reizleitung durch den AV-Knoten (Hulsmans & Clauss, Cell, 2017). Dabei entsteht eine elektrische Kopplung von CRMs und Kardiomyozyten über Connexin-43-Gap-Junction, wodurch CRMs die Reizleitung durch den AV-Knoten regulieren.
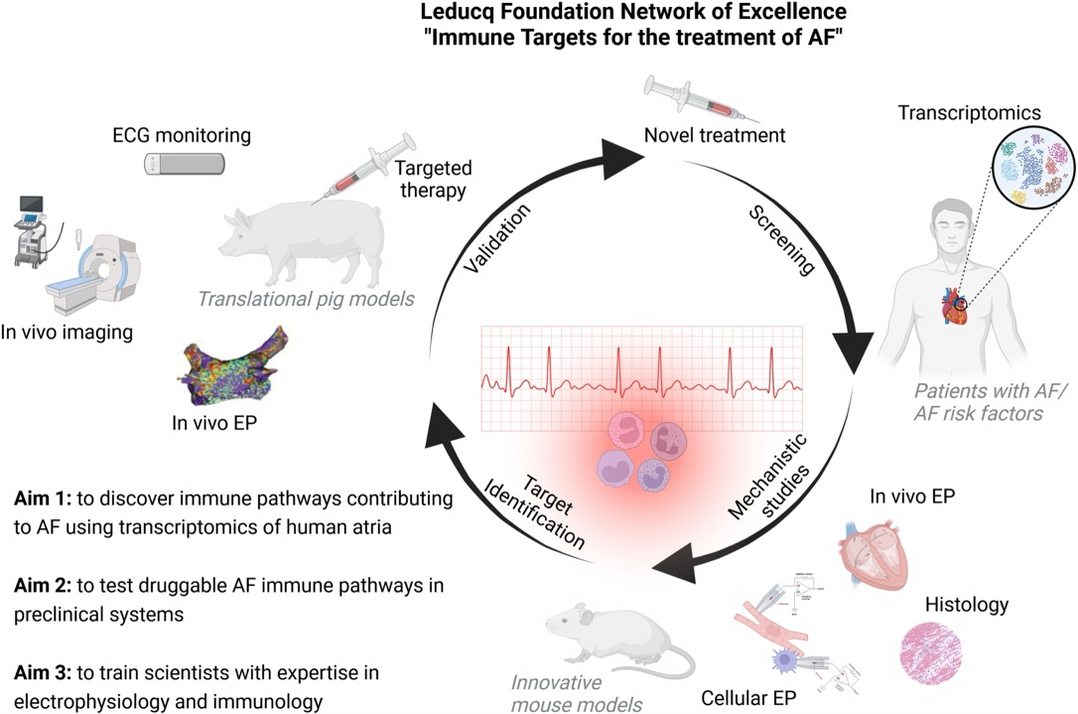
Die Übertragung dieser Entdeckung auf pathologische Prozesse identifizierte rekrutierte Makrophagen als wichtigen Faktor in der Pathogenese von Vorhofflimmern (Hulsmans et al., Science, 2023). Jedoch bleibt es weiterhin eine große Herausforderung diese Ergebnisse aus Mausversuchen in die Klinik zu übertragen. Unter anderem aufgrund der unterschiedlichen Herzgröße zwischen Maus und Mensch, welche ein wichtiger Faktor bei der Arrhythmie Entstehung ist.
Mithilfe unseres HOMER-Schweinemodells (Hypertension, Obesity, Mitral Regurgitation) für Vorhofflimmern setzen wir es uns zum Ziel, die derzeitigen Lücken in der Pathogenese zu schließen, neue Mechanismen zu identifizieren und diesen mit eigens entwickelten Therapien entgegenzuwirken.
-
Ausgewählte Publikationen
1. Clauss S., Nahrendorf M., Kääb S. Leducq-funded programme: immune targets for the treatment of atrial fibrillation, Eur. Heart J. 2025 July 1. doi: 10.1093/eurheartj/ehaf176.
2. Xia R, Tomsits P, Loy S, Zhang Z., Pauly V., Schüttler D., Clauss S. Cardiac Macrophages and Their Effects on Arrhythmogenesis. Front Physiol. 2022 June 20. doi:10.3389/fphys.2022.900094
3. Schüttler D., Bapat A., Kääb S., Lee K., Tomsits P., Clauss S.*, Hucker W.* Animal Models of Atrial Fibrillation. Circ Res. 2020 June 18. doi: 10.1161/CIRCRESAHA.120.31636
4. Clauss S.*, Schüttler D.*, Bleyer C., Vlcek J., Shakarami M., Tomsits P., Schneider S., Maderspacher F., Chataut K., Trebo A., Wang C., Kleeberger J., Xia R., Baloch E., Hildebrand B., Massberg S., Wakili R., Kääb S. Characterization of a porcine model of atrial arrhythmogenicity in the context of ischaemic heart failure. PLoS One. 2020 May 4. doi: 10.1371/journal.pone.0232374
5. Clauss S., Bleyer C., Schüttler D., Tomsits P., Renner S., Klymiuk N., Wakili R., Massberg S., Wolf E., Kääb S. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nat Rev Cardiol. 2019 Mar 20. doi: 10.1038/s41569-019-0179-0.
6. Hulsmans M.*, Clauss S.*, Xiao L.*, Aguirre AD., King KR., Hanley A., Hucker WJ., Wülfers EM., Seemann G., Courties G., Iwamoto Y., Sun Y., Savol AJ., Sager HB., Lavine KJ., Fishbein GA., Capen DE., Da Silva N., Miquerol L., Wakimoto H., Seidman CE., Seidman JG., Sadreyev RI., Naxerova K., Mitchell RN., Brown D., Libby P., Weissleder R., Swirski FK., Kohl P., Vinegoni C., Milan DJ., Ellinor PT., Nahrendorf M. Macrophages Facilitate Electrical Conduction in the Heart. Cell. 2017 April 20. doi: 10.1016/j.cell.2017.03.050
7. Clauss S., Wakili R., Hildebrand B., Kääb S., Hoster E., Klier I., Martens E., Hanley A., Hanssen H., Halle M., Nickel T. MicroRNAs as Biomarkers for Acute Atrial Remodeling in Marathon Runners (The miRathon Study - A Sub-Study of the Munich Marathon Study). PLoS One. 2016 Feb 9. doi: 10.1371/journal.pone.0148599
Unsere Methoden im Journal of Visualized Experiments, JoVE
1. Villgrater HE., Xia R., Sharma Chivukula A., Tomsits P., Clauss S. Microdissection and Immunofluorescence Staining of Myocardial Sleeves in Murine Pulmonary Veins. J Vis Exp. 2023(201). doi: 10.3791/65836
2. Clauss S. An Innovative Toolkit to Investigate the Complex Mechanisms of Cardiac Arrhythmias. J Vis Exp. 2023(192). doi: 10.3791/64932
3. Tomsits P., Sharma Chivukula A., Raj Chataut K., Simahendra A., Weckbach LT., Brunner S., Clauss S. Real-Time Electrocardiogram Monitoring during Treadmill Training in Mice. J Vis Exp. 2022(183). doi: 10.3791/63873
4. Xia R., Loy S., Kääb S., Titova A., Schulz C., Massberg S., Clauss S. Isolation and Culture of Resident Cardiac Macrophages from the Murine Sinoatrial and Atrioventricular Node. J Vis Exp. 2021(171). doi: 10.3791/62236
5. Tomsits P., Chataut KR., Chivukula AS., Mo L., Xia R., Schüttler D., Clauss S. Analyzing Long-Term Electrocardiography Recordings to Detect Arrhythmias in Mice. J Vis Exp. 2021(171). doi: 10.3791/62386
6. Xia R., Vlcek J., Bauer J., Kääb S., Ishikawa-Ankerhold H., van den Heuvel DA., Schulz C., Massberg S., Clauss S. Whole-Mount Immunofluorescence Staining, Confocal Imaging and 3D Reconstruction of the Sinoatrial and Atrioventricular Node in the Mouse. J Vis Exp. 2020(166). doi: 10.3791/62058
-

PD Dr. med. Sebastian Clauß
AG Leiter
Rijgcblgu-Hägf:WccvimsfuJl_vfiuyziuem:iJules Hamers (PhD)
Postdoktoral Fellow
k:fäic zgviDpcvimsfulhvfiSuyziuJsmiAdrian Blair
Postdoktoral Fellow
gmaplgu/jäglpvimsnfulGvfiuyziutmiDr. med. vet. Julia Vlcek
Tierärztin
Qfälg Öäyi:oYvim :fulhvfiudyziuemiValerie Pauly
Tierärztin und Doktorandin (Tiermedizin)
ÖgäiplWiePWgfäјvim-ful#vfiuynziu YmiShasha Zhu
Doktorandin (PhD)
czgczgtßzfvim fulhvfiuyziu miQifang Wu
Doktorandin (PhD)
Νlwgux UfWvim-,ful+vfiuyziusmiBetina Neumann
Doktorandin (PhD)
jiblugsuifvguuvim-ful+vfiuyziu miXiwen Zhang
Doktorandin (PhD)
ƒléiu ßzguxvim ful+vfiuyziu miKatharina Buchberger
Doktorandin (Dr. med.)
ÜgbzgplugeAfyzjipxipvimsfulGvfiuyziuemiHannes Villgrater
Doktorandin (Dr. med.)
Zguuic ÖlDääxpgbipviJmeful_vfiuyzdiuemiStefanie Muschler
Doktorandin (Dr. med.)
cdbiwgulievfcyzäipvim/fulhDvfiuyzi:utmiCaroline Ballweg
Doktorandin (Dr. med.)
Hgpüälui/Agääéixvimeful_vfiuyziuemiKatherina Klüver
Doktorandin (Dr. med.)
Alina Serter
Doktorandin (Dr. med.)
g,älug cipbipvim-fudl_vfiuyziu miTheresa Esser
Doktorandin (Dr. med.)
K,zipicg Nccipvim fulhvfiuyziu miBianca Hildebrand
Laborassistentin
jlguyg: zlämij:pgumviDmsfSulrvfiuyziu-mi









